Alunas do Cieac turno vespertino 2ºAno turma 05 Naiana e Mayara
Esse blog é um fundo de pesquisa para aquelas pessoas que usam a internet como um dos meios de estudo aprovetem do blog espero que ele ajude a voceis nossos leitores a estudar.Com esse trabalho esperamos que os alunos entendam a importância da Química e que ela esta presente em todos os momentos de nossa vida. Beijos Mayara e Naiana
sexta-feira, 30 de setembro de 2011
Curiosidades
Compressas de emergência
Uma aplicação interessante do calor de dissolução são as compressas de emergência,que estão á venda em vários países.Elas são usadas como primeiro-socorro nas contusões sofridas,por exemplo am praticas esportivas.
Existe a compressa quente,que é um saco de plástico com uma ampola de água e um produto químico seco (cloreto de cálcio ou sulfato de magnésio,por exemplo).Com uma leve pancada,a ampola se quebra e água dissolve o produto químico,liberando calor.
Analogamente,a compressa fria contém um produto químico de dissolução endotérmica ( como nitrato de amônio,por exemplo).
Essas compressas não são reutilizáveis e seu efeito dura cerca de 30 minutos.

Alunas do Cieac turno vespertino turma 2ºAno turma 05 Naiana e Mayara
Uma aplicação interessante do calor de dissolução são as compressas de emergência,que estão á venda em vários países.Elas são usadas como primeiro-socorro nas contusões sofridas,por exemplo am praticas esportivas.
Existe a compressa quente,que é um saco de plástico com uma ampola de água e um produto químico seco (cloreto de cálcio ou sulfato de magnésio,por exemplo).Com uma leve pancada,a ampola se quebra e água dissolve o produto químico,liberando calor.
Analogamente,a compressa fria contém um produto químico de dissolução endotérmica ( como nitrato de amônio,por exemplo).
Essas compressas não são reutilizáveis e seu efeito dura cerca de 30 minutos.

Alunas do Cieac turno vespertino turma 2ºAno turma 05 Naiana e Mayara
Resenhas Voçê Sabia !
- Na queima do carvão,jogamos fora os produtos químicos da reação (CO e CO ) e aproveitamos apenas o calor
- Velas foram inventadas para produzir luz,mas produzem também calor.
- Uma bateria elétrica,se usada muito intensamente ,acaba por se aquecer,isto é , além de energia elétrica,libera também calor.
- O motor do automóvel foi inventado para produzir movimento,mas ele se aquece,isto é,libera também calor.
Termoquímica é o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas.
A energia total após a reação é igual á energia total antes da reação.
A energia não pode ser criada nem destruída,apenas transaformada.
Transforme Sol em eletricidade = http://www.energiapura.com
Junte-se à Energia Pura.
Alunas do Cieac turno vespertino 2ºAno turma 05 Naiana e Mayara
Junte-se à Energia Pura.
Alunas do Cieac turno vespertino 2ºAno turma 05 Naiana e Mayara
quarta-feira, 28 de setembro de 2011
Termoquímica
Tópicos:
1. A energia e as Transaformações
2. Por que as reações químicas liberam ou absorvem calor?
3. Fatores que influem entalpias (ou calores) das reações.
Introdução
A vida moderna depende cada vez mais da energia -para movimentar as indústrias,para iluminar casas e escritorios para o funcionamento dos meios de transportes,para os sistemas de comunicação,etc. Até mesmo pra nossa diversão consome muita energia- o rádio,a televisão,a luz nas danceterias,o som ns shows de rock,etc. Enfim,nos dias atuais,energia,energia e energia sempre energia.
Obs: Não podemos esquecer também que são os alimentos que fornecem a energia necessária para manter a vida e toda atividade de nosso corpo.
1. A energia e as transformações da máteria:
As transformações fisícas e as reações químicas são,quase sempre acompanhadas por liberação ou absorção de calor, é vários fenômenos conhecidos ilustram bem essa fato.
A energia térmica do vapor de água por exemplo,era a energia utilizada nas antigas locomotivas a vapor,e, em nossos dias,essa energia é empregada para acionar modernas turbinas- em usinas termoelétrica,na propulsão de grandes navios,etc.
Alunas Naiana e Mayara do Cieac turno vespertino 2ºAno trurma 05
1. A energia e as Transaformações
2. Por que as reações químicas liberam ou absorvem calor?
3. Fatores que influem entalpias (ou calores) das reações.
Introdução
A vida moderna depende cada vez mais da energia -para movimentar as indústrias,para iluminar casas e escritorios para o funcionamento dos meios de transportes,para os sistemas de comunicação,etc. Até mesmo pra nossa diversão consome muita energia- o rádio,a televisão,a luz nas danceterias,o som ns shows de rock,etc. Enfim,nos dias atuais,energia,energia e energia sempre energia.
Obs: Não podemos esquecer também que são os alimentos que fornecem a energia necessária para manter a vida e toda atividade de nosso corpo.
1. A energia e as transformações da máteria:
As transformações fisícas e as reações químicas são,quase sempre acompanhadas por liberação ou absorção de calor, é vários fenômenos conhecidos ilustram bem essa fato.
A energia térmica do vapor de água por exemplo,era a energia utilizada nas antigas locomotivas a vapor,e, em nossos dias,essa energia é empregada para acionar modernas turbinas- em usinas termoelétrica,na propulsão de grandes navios,etc.
Alunas Naiana e Mayara do Cieac turno vespertino 2ºAno trurma 05
quarta-feira, 21 de setembro de 2011
Reações Quimicas
___________________________________________________________________________________________
As reações químicas fazem parte do nosso dia-a-dia. Por exemplo, quando vamos esquentar a água para preparar o café da manhã, estamos realizando uma reação química, pois o gás do fogão reage com o oxigênio do ar para produzir o calor que utilizamos para cozinhar os alimentos. Sabemos que para o carro andar devemos colocar gasolina. Mas o que a gasolina tem a ver com o movimento do carro?
Tipos de Reações Quimicas
As reações químicas costumam ocorrer acompanhadas de alguns efeitos que podem dar uma dica de que elas estão acontecendo.
Reações de Síntese


Reações de Decomposição
Como o próprio nome diz, este tipo de reação é o inverso da anterior (composição), ou seja, ocorrem quando a partir de um único composto são obtidos outros compostos. Estas reações também são conhecidas como reações de análise. Que tal dar uma olhadinha em uma ilustração e em alguns exemplos?


Reações de Simples Troca

Reações de Dupla Troca

Balanceamento de Equações Quimicas


| Devemos lembrar que para ajustar uma equação química usamos unicamente os coeficientes. Em nenhum caso trocamos os subíndices das fórmulas. Se fizermos isso vamos alterar a identidade da substância. Vamos ver um exemplo? |

| Os coeficientes usados no balanceamento de uma equação química devem ser sempre os menores números inteiros possíveis, pois não dá para imaginar 1/2 molécula de oxigênio! |



Importância do Estudo das Reações Químicas?
Já não se trata mais de falarmos em ensino de Química, mas de buscarmos a prática de uma EDUCAÇÃO QUÍMICA. Existe uma diferença fundamental entre essas duas formas de se abordar o processo ensino-aprendizagem em Química.
O ensino de Química subtende uma postura onde esse processo faz-se centrado no professor (que ensina) e, em situações extremas, pode resumir-se a ações em sala de aula. Já por Educação Química entendemos uma postura onde valoriza-se a construção de conhecimentos pelo aluno (que elabora conceitos) e a extensão do processo ensino-aprendizagem ao cotidiano, a práticas de pesquisa experimental, ao exercício da cidadania e ao resgate da História da Ciência como veículo contextualizador, humanizador e recurso instrucional importante.
A busca pela prática de uma Educação Química inicia com uma postura que é essencialmente humanista e filosófica: trata-se de formar o cidadão-aluno para sobreviver e atuar nesta sociedade científica-tecnológica onde a Química aparece como relevante instrumento para investigação, produção de bens, desenvolvimento sócio-econômico e interfere diretamente no cotidiano de todas as pessoas. Não é o caso de buscar-se a formação de cientistas porque nem todos os alunos que estudam Química serão pesquisadores ou seguirão alguma carreira acadêmica. É, principalmente, a chance de oferecer-se ao aluno a oportunidade de conhecer o método científico e utilizá-lo para resolver problemas do cotidiano, na busca de, parafraseando Jules Ferry, não apenas formarmos cientistas, mas formarmos cidadãos felizes.
Essa postura filosófica sedimenta-se e alicerça todas as ações de Educação Química que dela decorrem. A partir da opção pela Educação Química, segue-se a realização de atividades experimentais em laboratórios, a prática de pesquisas orientadas sobre tópicos em Química, excursões e visitas a indústrias, produção de textos e debates em sala de aula, tudo partindo desta nossa opção ideológica que visa educar cientificamente o cidadão.
Curiosidades
Reações Químicas do Corpo Humano
A ligação dos átomos e também a quebra dessas ligações constituem uma reação química em nosso corpo.
Quando uma ligação entre átomos é quebrada ocorre a liberação da chamada Energia Química, ela pode também ser absorvida nessa reação. E assim podemos melhorar nosso consumo e á produção de energia em nosso corpo.Mas você já parou para pensar que o crescimento de unhas e cabelos, desenvolvimento ósseo, cicatrizações de feridas, reconstrução celular vem de onde??? Pois bem tudo diz respeito a reações onde ocorre a liberação da energia formando então tudo que diz respeito ao nosso carpo, e essas reações também permitem manter nosso corpo aquecido.
Como se vê dependemos das reações químicas até para sobrevivermos e também faz parte do metabolismo.
Bibliografia:
http://www.mundoeducacao.com.br/curiosidades/
A ligação dos átomos e também a quebra dessas ligações constituem uma reação química em nosso corpo.
Quando uma ligação entre átomos é quebrada ocorre a liberação da chamada Energia Química, ela pode também ser absorvida nessa reação. E assim podemos melhorar nosso consumo e á produção de energia em nosso corpo.Mas você já parou para pensar que o crescimento de unhas e cabelos, desenvolvimento ósseo, cicatrizações de feridas, reconstrução celular vem de onde??? Pois bem tudo diz respeito a reações onde ocorre a liberação da energia formando então tudo que diz respeito ao nosso carpo, e essas reações também permitem manter nosso corpo aquecido.
Como se vê dependemos das reações químicas até para sobrevivermos e também faz parte do metabolismo.
Bibliografia:
http://www.mundoeducacao.com.br/curiosidades/
Alunas do Cieac turno vespertino 2º Ano turma 05 Naiana e Mayara
sábado, 17 de setembro de 2011
Curiosidades
Por que os cabelos ficam brancos com a idade?

De acordo com as atuais teorias do envelhecimento, cabelos brancos surgem quando as estruturas que compõem as células se oxidam devido à ação dos radicais livres - tipos reativos de oxigênio capazes de provocar danos celulares. Os radicais livres são moléculas instáveis, com número ímpar de elétrons (partículas atômicas de carga negativa), que podem desequilibrar as funções celulares. No organismo, milhares de radicais livres, provenientes sobretudo do oxigênio (elemento vital para a transformação dos alimentos em energia) são formados e destruídos a cada minuto. A destruição é operada por antioxidantes naturais (as vitaminas C e E e as enzimas superóxido dismutase e catalase). Assim, mais de 95% do oxigênio absorvido na respiração são transformados em água no interior das células, enquanto os 5% restantes passam por outras etapas antes disso e permanecem sob a forma de radicais livres. A poluição ambiental, os maus hábitos alimentares, a vida sedentária e a própria idade contribuem para o aumento na produção dos radicais livres, que facilitam o surgimento de doenças e o envelhecimento precoce.
Até os 40/45 anos de idade, geralmente o organismo consegue vencer a luta contra os radicais livres, retirando-os da circulação sem grandes dificuldades. Depois, contudo, eles livres tendem a se acumular gradualmente no organismo, contribuindo para o surgimento não só de cabelos brancos como de doenças degenerativas (arterioesclerose e câncer), problemas nas articulações (reumatismo e artrose) e alterações na pele (rugas e manchas senis).
Às vezes, os cabelos embranquecem precocemente, em geral quando, além de ter predisposição genética para isso, a pessoa enfrenta problemas particulares graves. Numa situação de estresse emocional, por exemplo, o organismo libera grande quantidade de adrenalina, substância altamente oxidante que contribui para o aumento dos radicais livres na corrente sangüínea - e daí, para o surgimento de cabelos brancos.
Alunas do Cieac vespertino 2ºAno turma 05 Naiana e Mayara
Experimentos
COMO FAZER UMA LÂMPADA FLUORESCENTE
O que você precisa:
1. Refrigerante de limão, em uma garrafa pet de 300 ml , de preferência verde. Serve Sprite ou Soda Limonada;
2. Água oxigenada comum (peróxido de hidrogênio), dessas vendidas em farmácia.
3. Bicarbonato de sódio (NaHCO3), aquele pó branco e cristalino, que o pessoal usa para a azia ou acidez estomacal. Também vendido nas farmácias.
COMO PREPARAR
1. Tire da garrafa de refrigerante mais ou menos três quartos do conteúdo;
2. Coloque na garrafa uma pitada de bicarbonato de sódio, só a pontinha de uma colher de sopa.
3. Acrescente o equivalente a três tampas do frasco, de água oxigenada;
4. Tampe a garrafa e agite bem a mistura.
5. Apague a lúz e confira o resultado.
Alunas do Cieac vespertino 2ºAno turma 05 Naiana e Mayara
O que você precisa:
1. Refrigerante de limão, em uma garrafa pet de 300 ml , de preferência verde. Serve Sprite ou Soda Limonada;
2. Água oxigenada comum (peróxido de hidrogênio), dessas vendidas em farmácia.
3. Bicarbonato de sódio (NaHCO3), aquele pó branco e cristalino, que o pessoal usa para a azia ou acidez estomacal. Também vendido nas farmácias.
COMO PREPARAR
1. Tire da garrafa de refrigerante mais ou menos três quartos do conteúdo;
2. Coloque na garrafa uma pitada de bicarbonato de sódio, só a pontinha de uma colher de sopa.
3. Acrescente o equivalente a três tampas do frasco, de água oxigenada;
4. Tampe a garrafa e agite bem a mistura.
5. Apague a lúz e confira o resultado.
Alunas do Cieac vespertino 2ºAno turma 05 Naiana e Mayara
Principais ácidos,bases,óxidos e sais e suas aplicações
Você sabe que o vinagre e o limão são azedos. Além de azedos, são bons condutores de eletricidade: se você misturar sumo de limão ou vinagre numa porção de água e fizer passar por esta solução uma corrente elétrica na qual esteja acoplada uma lâmpada, poderá constatar que a lâmpada acende, comprovando assim a boa condução de eletricidade.
O cloreto de sódio, o sulfato de potássio e o bicarbonato de sódio, diferentemente do vinagre e do limão, apresentam sabor salgado. Mas quando dissolvidos em água também formam soluções que são boas condutoras de eletricidade.
Já a cal hidratada (usada em pintura) e o leite de magnésia têm sabor adstringente ("prende" a língua) e são substância iônicas que possuem em sua composição química apenas o radical OH como íon negativo (ânion). E ambas conduzem igualmente bem a eletricidade quando em solução.
Através desses exemplos, você pode perceber que determinada conjuntos de substância apresentam propriedades que são comuns a todas as substância pertencentes ao mesmo grupo.
O grupo de substâncias compostas que possuem propriedades químicas semelhantes recebe o nome de função química.
Existem quatro tipos de função química, que serão estudados a seguir: ácido, base, sal e óxido.
O principal critério de classificação de uma substância numa dessas funções é o tipo de íons que se formam quando ela é dissolvida em água.
Função química: conjunto de substâncias que apresentam propriedades e comportamentos químico semelhantes. As quatros principais funções químicas são: ácidos, bases, sais e óxidos.
Essas quatro funções são definidas usando - se como principal critério a formação de íons em soluções aquosas, e ainda o tipo de íons presente nessas soluções. Assim por exemplo, os ácidos, as bases e os sais formam íons diferentes, quando em solução aquosa. Formando íons, conduzem a corrente elétrica, em solução aquosa. São, por isso, chamados eletrólitos.
Eletrólito: substância que conduz a corrente elétrica, quando em solução aquosa.
· Têm sabor ácido (azedo); · Possuem hidrogênio em sua molécula e, quando dissolvidos, libertam o hidrogênio como cátion; · Em solução aquosa, conduzem a corrente elétrica; · Formam sais e água quando reagem com bases : Ácido + base >>> sal + água
Exemplo: ácido clorídrico reagindo com hidróxido de sódio (base) resulta o cloreto de sódio (sal) e água:
A reação HC1 + NaOH >>>> NaCI + H2O mostra um caso em que o ácido (ácido clorídrico) possui um hidrogênio na molécula que é ionizável: na reação, ele é substituído pelo Muitos ácidos possuem somente hidrogênios ácidos, mas alguns possuem somente também hidrogênio não ionizável.
Quando um ácido é dissociado transformam - se em cátions e os átomos que estavam ligados a eles transformam - se em ânions. Exemplos:
· O ácido clorídrico dissocia - se no cátion H+ e no ânion CI - : HCI H + CI -; · O ácido nítrico dissocia - se no cátion H+ e no ânion NO-3: HNO3 H + NO3
O nome dos oxiácidos mais comuns é formado pela palavra ácido, seguida de outra palavra formada pelo ânion, com a terminação ico: ácido fosfórico (H3PO4), ácido clórico (HCIO3) etc.
Quando os ácidos formados possuem um oxigênio a menos, recebendo a terminação oso, em lugar de ico: ácido fosforoso (H3PO3), ácido cloroso (HCIO2) etc. Existem ainda ácidos com um oxigênio a menos que os terminados em oso. Neste caso usa - se o prefixo hipo: ácido hipofosforoso (H3PO2), ácido hipocloroso (HCIO2) etc.
O nomes dos hidrácidos e formado pela palavra de ácido seguida de outra palavra formada pelo ânion, com a terminação ídrico: ácido clorídrico (HCI), ácido fluorídrico (HF), ácido sulfídrico (H2S), ácido iodídrico (HI) etc. Bases
As bases são compostos iônicos, sendo, portanto, eletrólitos; em solução aquosa, o ânion formado é sempre o radical hidroxila (OH-). O cátion varia, de acordo com a base. Assim, por exemplo, hidróxido de sódio (NaOH) dissocia - se, em solução aquosa, no ânion OH - e no cátion Na + . NaOH >>> Na + OH -
Base: eletrólito iônico que em solução aquosa, possui o íon hidroxila (OH-) como único ânion. Propriedades funcionais das bases
As bases apresentam as seguintes propriedades funcionais:
· Contêm o grupo hidroxila (OH-), que é um ânion monovalente; · Reagindo com ácidos, resultam em sais e água; · Conduzem corrente elétrica, quando em solução aquosa. · Tornam vermelha a fenolftaleína incolor, e tornam azul tornassol vermelho.
O nome das bases é formado pela palavra hidróxido seguida da preposição de e do nome do cátion: hidróxido de sódio (NaOH), hidróxido de potássio (KOH), hidróxido de alúminio [A1(OH)3] etc.
Alguns metais podem apresentar mais de uma valência e, assim, formar mais de uma base. Nesses casos, basta acrescentar, em algarismo romano, a valência do metal. Pode - se também indicar a valência maior pela terminação ico e a menor pela terminação oso. Exemplo: · Fe (OH)3 -hidróxido de ferro (III), ou hidróxido férrico; · Fe (OH)2 -hidróxido de ferro (II), ou hidróxido ferroso.
· Em solução aquosa, conduzem a corrente elétrica. · Reagem com os ácidos (neutralizando - os) para formar sal e água. · Decompõem - se quando aquecidas. · Mudam a cor dos indicadores (conforme o quadro comparativo da função ácido). Classificação das bases De acordo com o número de hidroxilas existentes nas bases (hidroxilas ionizáveis), podemos classifica - las do seguinte modo:
· Manobases - com apenas 1 hidroxila. Exemplos: NaOH hidróxido de sódio KOH hidróxido de potássio · Bibases (=dibases) - com 2 hidroxilas. Exemplos: Ca (OH)2 hidróxido de cálcio BA (OH)2 hidróxido de bário · Tribases - com 3 hidroxilas. Exemplos: AI (OH)3 hidróxido de alumínio Nomenclatura das bases Para dar nome a uma base, escrevemos hidróxido de seguido do nome do metal (cátion).
Exemplos: NaOH hidróxido de sódio KOH hidróxido de potássio Ca(OH)2 hidróxido de cálcio Ba(OH)2 hidróxido de bário
Os sais normais podem ser : · Sais oxigenados - os que derivam dos oxiacidos; · Sais não - oxigenados - os que derivam dos hidrácidos.
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
O cloreto de sódio, o sulfato de potássio e o bicarbonato de sódio, diferentemente do vinagre e do limão, apresentam sabor salgado. Mas quando dissolvidos em água também formam soluções que são boas condutoras de eletricidade.
Já a cal hidratada (usada em pintura) e o leite de magnésia têm sabor adstringente ("prende" a língua) e são substância iônicas que possuem em sua composição química apenas o radical OH como íon negativo (ânion). E ambas conduzem igualmente bem a eletricidade quando em solução.
Através desses exemplos, você pode perceber que determinada conjuntos de substância apresentam propriedades que são comuns a todas as substância pertencentes ao mesmo grupo.
O grupo de substâncias compostas que possuem propriedades químicas semelhantes recebe o nome de função química.
Existem quatro tipos de função química, que serão estudados a seguir: ácido, base, sal e óxido.
O principal critério de classificação de uma substância numa dessas funções é o tipo de íons que se formam quando ela é dissolvida em água.
O conceito de função química
As substância não apresentam todas o mesmo comportamento químico. Isso decorre do fato de que elas não têm todas as mesma propriedades, as mesma características. É possível, no entanto, reuni - las em grupos de substância com propriedade químicos semelhantes. Esse grupos chamam - se funções químicas.Função química: conjunto de substâncias que apresentam propriedades e comportamentos químico semelhantes. As quatros principais funções químicas são: ácidos, bases, sais e óxidos.
Essas quatro funções são definidas usando - se como principal critério a formação de íons em soluções aquosas, e ainda o tipo de íons presente nessas soluções. Assim por exemplo, os ácidos, as bases e os sais formam íons diferentes, quando em solução aquosa. Formando íons, conduzem a corrente elétrica, em solução aquosa. São, por isso, chamados eletrólitos.
Eletrólito: substância que conduz a corrente elétrica, quando em solução aquosa.
Ácidos
Os ácidos, embora sejam compostos moleculares, são eletrólitos, pois sua moléculas dissociam - se em íons, quando em solução aquosa e, assim, conduzem a corrente elétrica. Os ânions formados variam conforme o ácido, mas o cátion é sempre o hidrogênio (H+).Vejamos alguns exemplos:
Ácido Atuação mais comum Clorídrico Atua na digestão Acético Dá o sabor azedo ao vinagre. Cítrico Existem na laranja, limão, goiaba, etc.. Bórico Usado para curativos. Fênico Usado como desinfetante pelos dentistas. sulfúrico Usado nas baterias dos veículos. Fórmico Eliminado pelas formigas, provocando a sensação de queimadura.Propriedades funcionais dos ácidos
As principais propriedades funcionais do ácidos são:· Têm sabor ácido (azedo); · Possuem hidrogênio em sua molécula e, quando dissolvidos, libertam o hidrogênio como cátion; · Em solução aquosa, conduzem a corrente elétrica; · Formam sais e água quando reagem com bases : Ácido + base >>> sal + água
Exemplo: ácido clorídrico reagindo com hidróxido de sódio (base) resulta o cloreto de sódio (sal) e água:
HCI + NAOH >>>> NACI + H2O.
· Descoram a fenolftaleína vermelha e fazem o tornassol azul tornar - se vermelho. A fenolftaleína e o tornassol apresentam cores diferentes, conforme estejam em meio ácido ou básico. São, por isso, chamados de indicadores ácido - base.Hidrogênio Ionizável
Hidrogênio ionizável ou hidrogênio ácido é o átomo de hidrogênio existentes na molécula do ácido e que poder ser substituído por metal.A reação HC1 + NaOH >>>> NaCI + H2O mostra um caso em que o ácido (ácido clorídrico) possui um hidrogênio na molécula que é ionizável: na reação, ele é substituído pelo Muitos ácidos possuem somente hidrogênios ácidos, mas alguns possuem somente também hidrogênio não ionizável.
Quando um ácido é dissociado transformam - se em cátions e os átomos que estavam ligados a eles transformam - se em ânions. Exemplos:
· O ácido clorídrico dissocia - se no cátion H+ e no ânion CI - : HCI H + CI -; · O ácido nítrico dissocia - se no cátion H+ e no ânion NO-3: HNO3 H + NO3
Classificação dos ácidos
Os ácidos podem ser distribuídos por dois grandes grupos, tomando como critério de classificação a presença ou a ausência de oxigênio em suas moléculas: oxiácidos e hidrácidos.Oxiácidos
Oxiácidos são os ácido que contêm oxigênio na sua molécula. Exemplos: ácido sulfúrico (H2SO4) e ácido nítrico (HNO3).O nome dos oxiácidos mais comuns é formado pela palavra ácido, seguida de outra palavra formada pelo ânion, com a terminação ico: ácido fosfórico (H3PO4), ácido clórico (HCIO3) etc.
Quando os ácidos formados possuem um oxigênio a menos, recebendo a terminação oso, em lugar de ico: ácido fosforoso (H3PO3), ácido cloroso (HCIO2) etc. Existem ainda ácidos com um oxigênio a menos que os terminados em oso. Neste caso usa - se o prefixo hipo: ácido hipofosforoso (H3PO2), ácido hipocloroso (HCIO2) etc.
Hidrácidos
Hidrácidos são os ácidos que não contêm oxigênio na sua molécula. Exemplos: ácido cloridrico (HCI) e ácido fluorídrico (HF).O nomes dos hidrácidos e formado pela palavra de ácido seguida de outra palavra formada pelo ânion, com a terminação ídrico: ácido clorídrico (HCI), ácido fluorídrico (HF), ácido sulfídrico (H2S), ácido iodídrico (HI) etc. Bases
As bases são compostos iônicos, sendo, portanto, eletrólitos; em solução aquosa, o ânion formado é sempre o radical hidroxila (OH-). O cátion varia, de acordo com a base. Assim, por exemplo, hidróxido de sódio (NaOH) dissocia - se, em solução aquosa, no ânion OH - e no cátion Na + . NaOH >>> Na + OH -
Base: eletrólito iônico que em solução aquosa, possui o íon hidroxila (OH-) como único ânion. Propriedades funcionais das bases
As bases apresentam as seguintes propriedades funcionais:
· Contêm o grupo hidroxila (OH-), que é um ânion monovalente; · Reagindo com ácidos, resultam em sais e água; · Conduzem corrente elétrica, quando em solução aquosa. · Tornam vermelha a fenolftaleína incolor, e tornam azul tornassol vermelho.
O nome das bases é formado pela palavra hidróxido seguida da preposição de e do nome do cátion: hidróxido de sódio (NaOH), hidróxido de potássio (KOH), hidróxido de alúminio [A1(OH)3] etc.
Alguns metais podem apresentar mais de uma valência e, assim, formar mais de uma base. Nesses casos, basta acrescentar, em algarismo romano, a valência do metal. Pode - se também indicar a valência maior pela terminação ico e a menor pela terminação oso. Exemplo: · Fe (OH)3 -hidróxido de ferro (III), ou hidróxido férrico; · Fe (OH)2 -hidróxido de ferro (II), ou hidróxido ferroso.
Característica das bases
Dentre as suas característica principais, destacamos: · Têm sabor cáustico (= adstringente ou lixívia) · Em solução aquosa, dissociam - se em íons OH- (hidroxila ou oxidrila) exemplos: Na + OH - >>> Na+ + OH - K+ OH- >>> K+ OH -· Em solução aquosa, conduzem a corrente elétrica. · Reagem com os ácidos (neutralizando - os) para formar sal e água. · Decompõem - se quando aquecidas. · Mudam a cor dos indicadores (conforme o quadro comparativo da função ácido). Classificação das bases De acordo com o número de hidroxilas existentes nas bases (hidroxilas ionizáveis), podemos classifica - las do seguinte modo:
· Manobases - com apenas 1 hidroxila. Exemplos: NaOH hidróxido de sódio KOH hidróxido de potássio · Bibases (=dibases) - com 2 hidroxilas. Exemplos: Ca (OH)2 hidróxido de cálcio BA (OH)2 hidróxido de bário · Tribases - com 3 hidroxilas. Exemplos: AI (OH)3 hidróxido de alumínio Nomenclatura das bases Para dar nome a uma base, escrevemos hidróxido de seguido do nome do metal (cátion).
Exemplos: NaOH hidróxido de sódio KOH hidróxido de potássio Ca(OH)2 hidróxido de cálcio Ba(OH)2 hidróxido de bário
Sais
Os sais são composto iônicos, sendo, portanto, eletrólitos; são formados por uma reação entre um ácido e uma base. Nessa reação, conhecida por reação de salificação, ou de neutralização, além do sal forma - se também água. ÁCIDO + BASE >>> SAL + ÁGUA Assim, por exemplo, o sal mais conhecido de todos, o cloreto de sódio, usado em cozinha, pode ser obtido por uma reação entre ácido clorídrico (HCI) e o hidróxido de sódio (NaOH): HCI + NaOH >>> NaCI + H2O Em solução aquosa, os sais sempre dão pelo menos um cátion diferente do H+ ou um ânion do OH-. Assim, o cloreto de sódio, por exemplo, dá o cátion Na+ e o ânion CI-. Sal: eletrólito iônico formado por uma reação entre um ácido e uma base. Propriedades funcionais dos sais As principais propriedades funcionais dos sais são: · Geralmente possuem sabor salgado; · Conduzem corrente elétrica, quando em solução aquosa; · Podem reagir com ácidos, com bases, com outros sais e com metais. Reações com sais · Sal reagindo com ácido resulta em outro sal e outro ácido. Exemplo: AgNO3 + HCI >>> AgCI + HNO3 · Sal reagindo com base resulta em outro sal e outra base. Exemplo: K2CO3 + Ca(OH)2 >>> CaCO3 + 2KOH · Sal reagindo com sal, resulta em dois novos sais, por uam reação de dupla troca. Exemplo: NaCI + AgNO3 >>> NaNO3 + AgCI · Sal reagindo com metal resulta em outro sal e outro metal, através de uma reação de simples troca. Exemplo: K + NaCI >>> Na + KCITipos de sais
Os sais podem ser normais, básicos e duplos. Aqui estudaremos apenas os sais normais.Os sais normais podem ser : · Sais oxigenados - os que derivam dos oxiacidos; · Sais não - oxigenados - os que derivam dos hidrácidos.
Óxidos
Os óxidos são composto iônicos ou moleculares sujas moléculas são formadas por átomo de dois elementos químicos, sendo um deles o oxigênio. Exemplos: óxido de zinco (ZnO) e óxido de nitrogênio (N2O5). Note que, no primeiro exemplo, o átomo que combina com oxigênio é de um metal (zinco); no segundo exemplo, é de um não - metal (nitrogênio). Óxidos: composto binário em que um dos elementos é o oxigênio.Nomenclatura dos óxidos
O nome dos óxidos pode ser dado simplesmente utilizando a palavra óxido, seguida da preposição de e do nome do elemento químico está combinado com oxigênio . exemplos: óxidos de cálcio (CaO), óxido de zinco (ZnO), óxido de alumínio (Al2O3) etc. É preferível, no entanto, utilizar prefixos do número de átomos de oxigênio: monóxido de cálcio (CaO), dióxido depentório de nitrogênio (N2O5).Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
sexta-feira, 16 de setembro de 2011
Sais e cotidiano
.jpg)
O sal carbonato de cálcio é encontrado nos recifes de corais e nas pérolas.
Sais são compostos que podem ser encontrados na natureza, ao nosso redor existe uma infinidade de sais, que fazem parte dos mais variados materiais.
O sal encontrado em nossa cozinha é o cloreto de sódio (NaCl), conhecido também como sal marinho ou sal-gema. É um sólido cristalino que além de ser usado para salgar a comida, tem larga aplicação na conservação de alimentos (carne seca, bacalhau, etc), na composição do soro fisiológico (uma mistura de água com 0,9% de cloreto de sódio) e como matéria prima para produção de cloro, de soda cáustica e de hipoclorito de sódio.
O carbonato de cálcio (CaCO3) é um sólido branco insolúvel em água, encontrado no calcário, na calcita, no mármore, etc. Está presente também nas cascas de ovos, nas pérolas e nos recifes de corais. Na indústria é utilizado na fabricação do cimento, vidro, da cal virgem, etc. Na agricultura é usado para correção da acidez do solo e nas siderúrgicas como fundente.
O sal encontrado em nossa cozinha é o cloreto de sódio (NaCl), conhecido também como sal marinho ou sal-gema. É um sólido cristalino que além de ser usado para salgar a comida, tem larga aplicação na conservação de alimentos (carne seca, bacalhau, etc), na composição do soro fisiológico (uma mistura de água com 0,9% de cloreto de sódio) e como matéria prima para produção de cloro, de soda cáustica e de hipoclorito de sódio.
O carbonato de cálcio (CaCO3) é um sólido branco insolúvel em água, encontrado no calcário, na calcita, no mármore, etc. Está presente também nas cascas de ovos, nas pérolas e nos recifes de corais. Na indústria é utilizado na fabricação do cimento, vidro, da cal virgem, etc. Na agricultura é usado para correção da acidez do solo e nas siderúrgicas como fundente.

O vidro é usado na fabricação de utensílios domésticos.
O carbonato de sódio (Na2CO3) é um pó branco ou levemente acizentado. É chamado popularmente de soda ou barrilha, é usado na fabricação de sabões e detergentes, celulose e papel, como desengraxante, na refinação do petróleo, e limpeza em geral. É empregado nas estações municipais de tratamento de água, em piscinas (para evitar que a água fique mais ácida) e ainda na fabricação de vidros.
O bicarbonato de sódio ou carbonato ácido de sódio (NaHCO3) é um sal ácido que reage com água liberando CO2 e produzindo NaOH. Nos efervescentes que combatem à acidez estomacal, o bicarbonato de sódio é princípio ativo, é usado também como fermento em pães. Nos extintores de incêndio (pó seco ou úmido) é um dos componentes principais.
O bicarbonato de sódio ou carbonato ácido de sódio (NaHCO3) é um sal ácido que reage com água liberando CO2 e produzindo NaOH. Nos efervescentes que combatem à acidez estomacal, o bicarbonato de sódio é princípio ativo, é usado também como fermento em pães. Nos extintores de incêndio (pó seco ou úmido) é um dos componentes principais.

O fluoreto de sódio (NaF2) serve como fonte de fluoreto para a formação do esmalte dental, que aumenta a resistência à formação de cáries. É usado em algumas pastas de dente e em enxaguatórios bucais.
O salitre - nitrato de potássio (KNO3) e o salitre-do-chile - nitrato de sódio (NaNO3), são empregados como conservantes dos embutidos de carne (presunto, salame, mortadela, rosbife, etc, e como afrodisíaco. Tomam parte também, da composição de fertilizantes, de dinamites e da chamada pólvora negra (uma mistura de salitre, carvão e enxofre pulverizados).
O salitre - nitrato de potássio (KNO3) e o salitre-do-chile - nitrato de sódio (NaNO3), são empregados como conservantes dos embutidos de carne (presunto, salame, mortadela, rosbife, etc, e como afrodisíaco. Tomam parte também, da composição de fertilizantes, de dinamites e da chamada pólvora negra (uma mistura de salitre, carvão e enxofre pulverizados).

O sulfito de sódio (Na2SO3) é um sólido cristalino usado na conservação de alimentos, refinação de açúcar, na clarificação do papel sulfite.
Veja a lista de alguns sais que possuem aplicações relevantes na medicina:Bicarbonato de sódio (NaHCO3) - Antiácido;
Carbonato de amônio (NH4)2CO3 - Expectorante;
Carbonato de lítio (Li 2CO3 ) - Antidepressivo;
Cloreto de amônio (NH 4Cl) - Acidificante do tubo digestivo;
Cloreto de sódio (NaCl) - Soro fisiológico;
Fluoreto de estanho II (SnF2) - Fortalecimento do esmalte dental;
Iodeto de sódio (NaI) - Fonte de iodo para a tireóide;
Iodeto de potássio (KI) - Fonte de iodo para a tireóide;
Nitrato de potássio (KNO3) - Diurético;
Permanganato de potássio ( KMnO4) - Antimicótico;
Sulfato de bário (BaSO 4) - Contraste em radiografia intestinal;
Sulfato de cálcio (CaSO4) - Gesso para imobilizações;
Sulfato de ferro II (FeSO4) - Fonte de ferro para anêmicos;
Nitrato de potássio (KNO3) - Germicida para olhos de recém nascidos;
Sulfato de magnésio (MgSO4) - Laxante.
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
Tabela de pH e como funciona
pH é uma medida da acidez e alcalinidade. A escala de pH vai de 0 a 14. Em 7 pH, que é bem na metade, há um equilíbrio entre acidez e alcalinidade. Esse tipo de solução
é neutra.
Os princípios do pH começam com a definição do termo pH. O p, vem da palavra poder. O H, é claro, é o símbolo para o elemento hidrogênio. Juntos, o termo pH significa atividade do íon hidrogênio. Quanto maior a potência de uma substância de liberar íons hidrogenados, menor é o valor pH. Então, quanto maior for o grau de acidez, menor será a leitura do pH.
A escala de pH é logarítmica, isso significa que os valores que separam cada unidade não são de valores iguais ao longo da escala, mas aumento de acordo e proporção de sua distancia do meio ponto, para terem um equilíbrio certo entre acidez e alcalinidade.

Os valores são multiplicados por cada unidade. Como resultado o valor de ph de 6 é 10 vezes mais ácido do que o valor de pH do 7, mas um pH de 5 é 100 vezes mais ácido
do que um ph de 7. No contrário, um pH de 8 é 10 vezes
mais alcalino do que um pH de 7, e um pH de 9 é 100 vezes mais alcalino do que um pH de 7.
Lembre-se: Quando testando o pH da sua saliva ou urina, enquanto um resultado de 5.5 pode parecer muito ácido (na verdade, é somente 1.25 unidades abaixo de 7), certamente
é bem ácido. De fato, é 50 vezes mais ácido do que é considerado saudável.
Outro lembrete importante é para que possa reverter isso, e neutralizar a acidez, é requerido uma grande quantidade de elementos alcalinos. A combinação seria algo assim:
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
é neutra.
Os princípios do pH começam com a definição do termo pH. O p, vem da palavra poder. O H, é claro, é o símbolo para o elemento hidrogênio. Juntos, o termo pH significa atividade do íon hidrogênio. Quanto maior a potência de uma substância de liberar íons hidrogenados, menor é o valor pH. Então, quanto maior for o grau de acidez, menor será a leitura do pH.
A escala de pH é logarítmica, isso significa que os valores que separam cada unidade não são de valores iguais ao longo da escala, mas aumento de acordo e proporção de sua distancia do meio ponto, para terem um equilíbrio certo entre acidez e alcalinidade.

Os valores são multiplicados por cada unidade. Como resultado o valor de ph de 6 é 10 vezes mais ácido do que o valor de pH do 7, mas um pH de 5 é 100 vezes mais ácido
do que um ph de 7. No contrário, um pH de 8 é 10 vezes
mais alcalino do que um pH de 7, e um pH de 9 é 100 vezes mais alcalino do que um pH de 7.
Lembre-se: Quando testando o pH da sua saliva ou urina, enquanto um resultado de 5.5 pode parecer muito ácido (na verdade, é somente 1.25 unidades abaixo de 7), certamente
é bem ácido. De fato, é 50 vezes mais ácido do que é considerado saudável.
Outro lembrete importante é para que possa reverter isso, e neutralizar a acidez, é requerido uma grande quantidade de elementos alcalinos. A combinação seria algo assim:
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
Para que possa mudar o Ph de um galão de solução com um pH de 5.5 para 7, vai requerer mais de 20 galões de uma solução com um pH de 7.5.
Importância das Bases
Segundo Arrhenius, uma base (também chamada de álcali) é qualquer substância que libera única e exclusivamente o ânion OH– (íons hidroxila ou oxidrila) em solução aquosa. Soluções com estas propriedades dizem-se básicas ou alcalinas. As bases possuem baixas concentrações de ions H+ sendo considerado base as soluções que têm, a 25 °C, pH acima de 7. Possuem sabor adstringente (ou popularmente, cica) e são empregadas como produtos de limpeza, medicamentos (antiácidos) entre outros. Muitas bases, como o hidróxido de magnésio (leite de magnésia) são fracas e não trazem danos. Outras como o hidróxido de sódio (NaOH ou soda cáustica) são corrosivas e sua manipulação deve ser feita com cuidado. Quando em contato com o papel tornassol vermelho apresentam a cor azul-marinho ou violeta.
Em 1923, o químico dinamarquês Johannes Nicolaus Brønsted e o inglês Thomas Martin Lowry propuseram a seguinte definição: Uma base é um aceitador de prótons (íon hidrônio H+)
Mais tarde Gilbert Lewis definiu como base qualquer substância que doa pares de elétrons não ligantes, numa reação química - doador do par electrônico.- (ácido sulfúrico + hidróxido de cálcio = água + sulfato de cálcio)
- (ácido clorídrico + hidróxido de sódio = água + cloreto de sódio)
Soda Cáustica(NaOH) Apresenta ocasionalmente uso doméstico para a desobstrução de encanamentos e sumidouros, pois dissolve gorduras e sebos. É altamente corrosivo e pode produzir queimaduras, cicatrizes e cegueira devido à sua elevada reatividade.
Leite de magnésia (Mg(OH)2)
Sua ação laxante deve-se à reação dela com o ácido clorídrico do suco gástrico, formando cloreto de magnésio - MgCl2 - que é deliquescente, ou seja, absorve muita umidade, chegando até mesmo a se dissolver na água absorvida do meio. Desse modo, lubrifica-se os intestinos, neutralizando a prisão de ventre.
Em doses moderadas, serve também para ação antiácida, devido às suas propriedades alcalinas, reação de salinização do ácido clorídirico), mas prefere-se os bicarbonatos para tal.Cal hidratada (apagada) (Ca(OH)2)
Esta substância é normalmente utilizada na indústria da construção civil para elaboração das argamassas com que se erguem as paredes e muros e também na pintura. A cal também tem emprego na indústria cerâmica, siderúrgicas (obtenção do ferro) e farmacêutica como agente branqueador ou desodorizador. Na agricultura, o óxido de cálcio é usado para produzir hidróxido de cálcio, que tem por finalidade o controle da acidez dos solos e, na metalurgia extrativa, é utilizado para separar a escória (que contém impurezas, especialmente areia) do ferro.
Cloro de piscina
No estado puro, na sua forma biatômica (Cl2) e em condições normais de temperatura e pressão, é um gás de coloração amarelo esverdeada, sendo duas vezes e meia mais pesado que o ar. É abundante na natureza e é um elemento químico essencial para muitas formas de vida.
Água do mar (devido aos sais e outras substâncias diluídas nessa água, ela apresenta um pH relativamente alto, pois isso a torna básica)
A água é essencial para os humanos e para as outras formas de vida. Ela age como reguladora de temperatura, diluidora de sólidos e transportadora de nutrientes e resíduos por entre os vários órgãos. Bebemos água para ajudar na diluição e funcionamento normal dos órgãos para em seguida ser eliminada pela urina e por evaporação nos poros, mantendo a temperatura corporal e eliminando resíduos solúveis, como sais e impurezas. As lágrimas são outro exemplo de eliminação de água.Na indústria ela desempenha o mesmo papel de diluidora, transportadora e resfriadora nos vários processos de manufatura e transformações de insumos básicos em bens comerciais.
Antiácidos em geral
Um antiácido é qualquer substâncias, normalmente uma base, cuja função é neutralizar a acidez estomacal. É comum a utilização do bicarbonato de sódio (NaHCO3), que ao reagir com o ácido clorídrico(HCl) presente no estômago resulta em cloreto de sódio (substância neutra), água e gás carbônico.
Amônia (NH3)Muito usado em ciclos de compressão (refrigeração) devido ao seu elevado calor de vaporização e temperatura crítica. Também é utilizado em processos de absorção em combinação com a água.
A amônia e seus derivados ureia, nitrato de amônio e outros são usados na agricultura como fertilizantes. Também é componente de vários produtos de limpeza. Outro produto importante derivado da amônia é o ácido nítrico.
Apesar das Vantagens, o amoníaco apresenta também alguns riscos:
Ingestão: Perigoso. Os sintomas incluem náusea e vômitos, causando danos aos lábios, boca e esôfago.
Inalação: Os vapores são extremamente irritantes e corrosivos.
Pele: Soluções concentradas podem produzir queimaduras severas e necroses.
Olhos: Pode causar danos permanentes, inclusive em quantidades pequenas.
Urina humana: A urina é normalmente estéril quando é expelida e tem apenas um vago odor. O cheiro desagradável de urina deteriorada deve-se à ação de bactérias que provocam a libertação de amoníaco.
Do ponto de vista químico, o sabão é um sal de ácido graxo. Tradicionalmente, o sabão é produzido por uma reação entre gordura e hidróxido de sódio e de potássio e carbonato de sódio, todos álcalis (bases) historicamente lixiviados das cinzas de madeiras de lei. A reação química que produz o sabão é conhecida como saponificação. A gordura e as bases são hidrolisadas em água; os gliceróis livres ligam-se com grupos livres de hidroxila para formar glicerina, e as moléculas livres de sódio ligam-se com ácidos graxos para formar o sabão.
O detergente mais comum é o sal para - Dodecil-benzeno-sulfonato de sódio, que se origina através da reação de soda com ácido sulfônico (dodecil-alquil-benzil-sulfônico).
Detergente
Sabão
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
terça-feira, 13 de setembro de 2011
Livro Química Ambiental
Pessoal, saca só: esse livro é ótimo! Achei perdido nos resultados de busca do google. Não é o Baird Química Ambiental, mas é bem próximo, se não melhor! Bom proveito para todos.
http://www.profmedeiros.com.br/arquivos/doc/livro/introdução.pdf
http://www.profmedeiros.com.br/arquivos/doc/livro/introdução.pdf
Funções Inorgânicas ( Ácidos,Bases,Ácidos e Sais )
Ácido
Definição:
Função Química é portanto o grupo de compostos que embora diferentes,possuem propriedades químicas semelhantes.
Principais funções químicas inorgânicas: ácidos,bases,sais e óxidos.
Ácidos Segundo Arrheunius,é toda substância que em solução aquosa se ionizam formando um cation chamado Hidrogênio ionizavel (H+) (ou H3O+ .
1.Ionização - reação entre moléculas que levará a produção de ions .
Alguns tipos de função ácido
A: HCl Cloreto de Hidrogênio
Quando ocorre sua dissolução na água, há a produção de ácidos clorídrico.
HCl(gás) Cloreto de Hidrogênio
HCl (aquoso) Ácido Clorídrico
B: H2SO4 Sulfato de Hidrogênio
Trata-se de um composto corrosivo que na presença de água reage violentamente produzindo ácido sulfúrico.
H2SO4 Sulfato de Hidrogénio
quando H2SO4 for (aquoso) ele vai ser - ácido Sulfúrico
As formulas são usadas tanto para ácidos como para os compostos que lhe dão origem.
-- Formula geral
HxE Ou HxEgO3
Ex: H2S Ex: H2cO3
Propriedades
monoácido.....................................1hidrogênio
diácidos...........................................2 hidrogênio
triacidos...........................................3 hidrogênios
tretacidos..........................................4 hidrogênio
Classificação
A- De acordo com o numero de elementos químicos.
Binário
ex: HBr
Tenario
ex: H3PO4
Quaternário
ex: H4Fe(CN)6
B-Quanto a presença de oxigênio
Hidróxidos - quando não tem oxigênio; Ex:HCN
Oxiácidos - quando tem oxigênio;
C- Quanto a volatividade
volatividade vem da palavra volátil
volátil: atomicidade (< 7) Ex: H2S
2+1=3
Fixo atomicidade (> 7) Ex:H3PO4
3+1+4=8
D- Quanto atomicidade ou grau de ionização
HIdrácidos- Forte :HI,HBr e HCl
Moderado :Hf
Fraca : Os demais
Oxiácidos - Fraco : 2 ou 3 Ex:H2SO4
Moderado : 1 Ex:H2 PO4
Fraco : 0
Nomes dos ânios
ácidos ânions
ídrico eto
oso ito
ico ato
Bases
É toda substância,que em solução aquosa,que libera como ânions chamado hidróxila ou oxidrila (OH-).
Nomes
Dá- se nome aos compostos que se originam delas.
Exemplo: M(OH)m - hidróxido de metal
Basta colocar o nome do metal em frente á expressão hidróxido.
Exemplo:
KOH - Hidróxido de Potássio
Fe(OH)2 - Hidroxido de Ferro II
Obs: Alguns elementos formam mais de um cátion e,por isso,deve-se representar com algarismo romano a valência do cátion.
Não se indica Nox fixo do metal no nome de seu hidróxido.
Nomes dados oas óxidos
Regra geral:
mono
di óxido de (nome do elemento)
tri
tetra
penta
hex
hept
Oxigênio com Nox igual a -2 e o elemento com Nox fixo
óxido + nome do elemento
Exceções: para os elementos B+3, C+4 e Si+4 só se usa o sufixo "ico".
Exemplos:
Sais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um cátion diferente de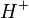 e pelo menos um ânion diferente de
e pelo menos um ânion diferente de  . São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.
. São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.
Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidade
Obs2: Como os sais são essencialmente iônicos
b) para oxissais
Usamos uma extensão da tabela de óxidos ácidos e oxiácidos, pois a nomenclatura dos oxissais também depende do nox.
Exceções: Como os elementos B+3, C+4 e Si+4 só possuem sufixo "ico" na forma de ácido, quando sais, usa-se sempre o sufixo "ato".
Exemplos:
Definição:
Função Química é portanto o grupo de compostos que embora diferentes,possuem propriedades químicas semelhantes.
Principais funções químicas inorgânicas: ácidos,bases,sais e óxidos.
Ácidos Segundo Arrheunius,é toda substância que em solução aquosa se ionizam formando um cation chamado Hidrogênio ionizavel (H+) (ou H3O+ .
1.Ionização - reação entre moléculas que levará a produção de ions .
Alguns tipos de função ácido
A: HCl Cloreto de Hidrogênio
Quando ocorre sua dissolução na água, há a produção de ácidos clorídrico.
HCl(gás) Cloreto de Hidrogênio
HCl (aquoso) Ácido Clorídrico
B: H2SO4 Sulfato de Hidrogênio
Trata-se de um composto corrosivo que na presença de água reage violentamente produzindo ácido sulfúrico.
H2SO4 Sulfato de Hidrogénio
quando H2SO4 for (aquoso) ele vai ser - ácido Sulfúrico
As formulas são usadas tanto para ácidos como para os compostos que lhe dão origem.
-- Formula geral
HxE Ou HxEgO3
Ex: H2S Ex: H2cO3
Propriedades
- Sabor azedo - Conduz em solução aquosa mudam de cor
- Entram em contato com o bicarbonato de sódio provoca efervecencia.
- Reagem com bases formando água e sal.
monoácido.....................................1hidrogênio
diácidos...........................................2 hidrogênio
triacidos...........................................3 hidrogênios
tretacidos..........................................4 hidrogênio
Classificação
A- De acordo com o numero de elementos químicos.
Binário
ex: HBr
Tenario
ex: H3PO4
Quaternário
ex: H4Fe(CN)6
B-Quanto a presença de oxigênio
Hidróxidos - quando não tem oxigênio; Ex:HCN
Oxiácidos - quando tem oxigênio;
C- Quanto a volatividade
volatividade vem da palavra volátil
volátil: atomicidade (< 7) Ex: H2S
2+1=3
Fixo atomicidade (> 7) Ex:H3PO4
3+1+4=8
D- Quanto atomicidade ou grau de ionização
HIdrácidos- Forte :HI,HBr e HCl
Moderado :Hf
Fraca : Os demais
Oxiácidos - Fraco : 2 ou 3 Ex:H2SO4
Moderado : 1 Ex:H2 PO4
Fraco : 0
Nomes dos ânios
ácidos ânions
ídrico eto
oso ito
ico ato
Bases
É toda substância,que em solução aquosa,que libera como ânions chamado hidróxila ou oxidrila (OH-).
Nomes
Dá- se nome aos compostos que se originam delas.
Exemplo: M(OH)m - hidróxido de metal
Basta colocar o nome do metal em frente á expressão hidróxido.
Exemplo:
KOH - Hidróxido de Potássio
Fe(OH)2 - Hidroxido de Ferro II
Obs: Alguns elementos formam mais de um cátion e,por isso,deve-se representar com algarismo romano a valência do cátion.
Não se indica Nox fixo do metal no nome de seu hidróxido.
Nomes dados oas óxidos
Regra geral:
mono
di óxido de (nome do elemento)
tri
tetra
penta
hex
hept
Oxigênio com Nox igual a -2 e o elemento com Nox fixo
óxido + nome do elemento
Solubilidade dos hidróxdos em água
Hidróxidos dos alcalinos - muito solúveis metal familia 1A e 2A
Totalmente solúveis → bases de metais alcalinos (1A) e o hidróxido de amônio (NH4OH).
Parcialmente solúveis → bases de metais alcalinos terrosos (2A).
Praticamente insolúveis → bases dos demais metais.
Exceção: O Be(OH)2 e Mg(OH)2 (bases da família 2A) são praticamente insolúveis.
CLASSIFICAÇÃO DAS BASES
Quanto ao número de hidroxilas na fórmula da base
Dibase → duas hidroxilas na fórmula da base.
Ex.: Ca(OH)2, Mg(OH)2, Zn(OH)2
Tribase → três hidroxilas na fórmula da base.
Ex.: Al(OH)3, Fe(OH)3, Mn(OH)3
Tetrabase → quatro hidroxilas na fórmula da base.
Ex.: Mn(OH)4, Sn(OH)4, Pb(OH)24
Quanto ao grau de dissociação (força das bases) Para que uma base se dissocie é necessário que esta base esteja dissolvida em água, com isso teremos:
É todo composto binário cujo elemento mais eletronegativo é o oxigênio.
A exceção é o fluor- único elemento mais eletronegativo que o xoigênio formando o composto (Floreto de oxigênio) que não é óxido.
Bases fortes → bases dos metais da família 1A e 2A.
Bases fracas → bases dos demais metais, Be(OH)2, Mg(OH)2 e NH4OH.
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
Exceção: O hidróxido de amônio (NH4OH) é uma base solúvel, mas que apresenta um pequeno grau de ionização, desta forma, esta base é classificada como solúvel e fraca.
Óxido
Óxidos são compostos binários em que o elemento oxigênio apresenta número de oxidação igual a -2 e é o mais eletronegativo da fórmula tornado-o o mais potente elemento.
As propriedades de um óxido dependem das características esperticunstulares do elemento formador.
Classificação dos óxidos
| classificação | formadores | exemplos |
|---|---|---|
| básicos | metais com nox +1 ou +2 e do grupo 1A e 2A | CaO, FeO, K2O |
| ácidos ou anidridos | metais com nox +5, +6 e +7 e ametais com qualquer nox, exceto C+2, N+1 e N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Os mais comuns são formados pelos metais Al, Mn, Zn, Pb e Sn | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mistos ou duplos | metais com nox médio +8/3 | Pb3O4, Fe3O3 |
Obs: os óxidos anfóteros se comportam como óxidos básicos na presença de ácidos e como óxidos ácidos na presença de bases.
Obs2: os óxidos mistos são a "soma" dos óxidos formados por um elemento, ou seja, é uma nuvem com todos os tipos de óxidos desse elemento:
- FeO + Fe2O3 → Fe3O4
Nomenclatura dos óxidos
a) para qualquer óxido- prefixo + óxido de + prefixo + elemento
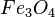 = tetróxido de triferro
= tetróxido de triferro
 = trióxido de dinitrogênio
= trióxido de dinitrogênio
- óxido de + elemento
 - óxido de sódio
- óxido de sódio
 - óxido de alumínio
- óxido de alumínio
- óxido + elemento + sufixo OU óxido de + elemento + nox em algarismo romano
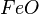 = óxido ferroso ou óxido de ferro II
= óxido ferroso ou óxido de ferro II
 = óxido férrico ou óxido de ferro III
= óxido férrico ou óxido de ferro III
- anidrido + prefixo + elemento + sufixo
| nox | prefixo | sufixo |
|---|---|---|
| +1 ou +2 | hipo | oso |
| +3 ou +4 | - | oso |
| +5 ou +6 | - | ico |
| +7 | (hi)per | ico |
Exceções: para os elementos B+3, C+4 e Si+4 só se usa o sufixo "ico".
Exemplos:
 = anidrido carbônico
= anidrido carbônico
 = anidrido permangânico
= anidrido permangânico
Nomenclatura dos peróxidos
- peróxido de + elemento
Nomenclatura dos superóxidos
- superóxido de + elemento
Sais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um cátion diferente de
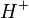 e pelo menos um ânion diferente de
e pelo menos um ânion diferente de  . São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.
. São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidade
Obs2: Como os sais são essencialmente iônicos
Classificação dos sais
a) de acordo com a presença de oxigênio- Sais halóides: não possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Oxissais: possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Sal normal: é formado pela neutralização completa entre um ácido e uma base. Não possui nem H+ nem OH-
- Exemplo:

- Exemplo:
- Hidrogenossal ou hidroxissal: é formado numa reação de neutralização quando o ácido e a base não estão em proporção estequiométrica. Sendo assim, há uma neutralização parcial, sobrando H+ ou OH-
- Exemplo (hidrogenossal):

- Exemplo (hidroxissal):
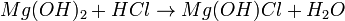
- Exemplo (hidrogenossal):
- Sal misto: o sal apresenta em sua fórmula mais de um cátion ou mais de um ãnion diferentes. É formado a partir da neutralização de um ácido por mais de uma base ou de uma base por mais de um ácido.
- Exemplo:

- Exemplo:
Nomenclatura dos sais
a) para sais halóides- ametal + eto de cátion
b) para oxissais
Usamos uma extensão da tabela de óxidos ácidos e oxiácidos, pois a nomenclatura dos oxissais também depende do nox.
| - | - | óxidos ácidos e oxiácidos | oxissais |
|---|---|---|---|
| nox | prefixo | sufixo | sufixo |
| +1 ou +2 | hipo | oso | ito |
| +3 ou +4 | - | oso | ito |
| +5 ou +6 | - | ico | ato |
| +7 | (hi)per | ico | ato |
Exceções: Como os elementos B+3, C+4 e Si+4 só possuem sufixo "ico" na forma de ácido, quando sais, usa-se sempre o sufixo "ato".
Exemplos:
 (nox N = +3) = nitrito de potássio
(nox N = +3) = nitrito de potássio
 (nox Cl = +1) = hipoclorito de sódio
(nox Cl = +1) = hipoclorito de sódio
 (nox Mn = +7) = permanganato de potássio
(nox Mn = +7) = permanganato de potássio
Monobase → uma hidroxila na fórmula da base.
Ex.: NaOH, KOH, AgOH
Assinar:
Postagens (Atom)









 =
= 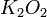
 =
=  =
=  =
=