Definição:
Função Química é portanto o grupo de compostos que embora diferentes,possuem propriedades químicas semelhantes.
Principais funções químicas inorgânicas: ácidos,bases,sais e óxidos.
Ácidos Segundo Arrheunius,é toda substância que em solução aquosa se ionizam formando um cation chamado Hidrogênio ionizavel (H+) (ou H3O+ .
1.Ionização - reação entre moléculas que levará a produção de ions .
Alguns tipos de função ácido
A: HCl Cloreto de Hidrogênio
Quando ocorre sua dissolução na água, há a produção de ácidos clorídrico.
HCl(gás) Cloreto de Hidrogênio
HCl (aquoso) Ácido Clorídrico
B: H2SO4 Sulfato de Hidrogênio
Trata-se de um composto corrosivo que na presença de água reage violentamente produzindo ácido sulfúrico.
H2SO4 Sulfato de Hidrogénio
quando H2SO4 for (aquoso) ele vai ser - ácido Sulfúrico
As formulas são usadas tanto para ácidos como para os compostos que lhe dão origem.
-- Formula geral
HxE Ou HxEgO3
Ex: H2S Ex: H2cO3
Propriedades
- Sabor azedo - Conduz em solução aquosa mudam de cor
- Entram em contato com o bicarbonato de sódio provoca efervecencia.
- Reagem com bases formando água e sal.
monoácido.....................................1hidrogênio
diácidos...........................................2 hidrogênio
triacidos...........................................3 hidrogênios
tretacidos..........................................4 hidrogênio
Classificação
A- De acordo com o numero de elementos químicos.
Binário
ex: HBr
Tenario
ex: H3PO4
Quaternário
ex: H4Fe(CN)6
B-Quanto a presença de oxigênio
Hidróxidos - quando não tem oxigênio; Ex:HCN
Oxiácidos - quando tem oxigênio;
C- Quanto a volatividade
volatividade vem da palavra volátil
volátil: atomicidade (< 7) Ex: H2S
2+1=3
Fixo atomicidade (> 7) Ex:H3PO4
3+1+4=8
D- Quanto atomicidade ou grau de ionização
HIdrácidos- Forte :HI,HBr e HCl
Moderado :Hf
Fraca : Os demais
Oxiácidos - Fraco : 2 ou 3 Ex:H2SO4
Moderado : 1 Ex:H2 PO4
Fraco : 0
Nomes dos ânios
ácidos ânions
ídrico eto
oso ito
ico ato
Bases
É toda substância,que em solução aquosa,que libera como ânions chamado hidróxila ou oxidrila (OH-).
Nomes
Dá- se nome aos compostos que se originam delas.
Exemplo: M(OH)m - hidróxido de metal
Basta colocar o nome do metal em frente á expressão hidróxido.
Exemplo:
KOH - Hidróxido de Potássio
Fe(OH)2 - Hidroxido de Ferro II
Obs: Alguns elementos formam mais de um cátion e,por isso,deve-se representar com algarismo romano a valência do cátion.
Não se indica Nox fixo do metal no nome de seu hidróxido.
Nomes dados oas óxidos
Regra geral:
mono
di óxido de (nome do elemento)
tri
tetra
penta
hex
hept
Oxigênio com Nox igual a -2 e o elemento com Nox fixo
óxido + nome do elemento
Solubilidade dos hidróxdos em água
Hidróxidos dos alcalinos - muito solúveis metal familia 1A e 2A
Totalmente solúveis → bases de metais alcalinos (1A) e o hidróxido de amônio (NH4OH).
Parcialmente solúveis → bases de metais alcalinos terrosos (2A).
Praticamente insolúveis → bases dos demais metais.
Exceção: O Be(OH)2 e Mg(OH)2 (bases da família 2A) são praticamente insolúveis.
CLASSIFICAÇÃO DAS BASES
Quanto ao número de hidroxilas na fórmula da base
Dibase → duas hidroxilas na fórmula da base.
Ex.: Ca(OH)2, Mg(OH)2, Zn(OH)2
Tribase → três hidroxilas na fórmula da base.
Ex.: Al(OH)3, Fe(OH)3, Mn(OH)3
Tetrabase → quatro hidroxilas na fórmula da base.
Ex.: Mn(OH)4, Sn(OH)4, Pb(OH)24
Quanto ao grau de dissociação (força das bases) Para que uma base se dissocie é necessário que esta base esteja dissolvida em água, com isso teremos:
É todo composto binário cujo elemento mais eletronegativo é o oxigênio.
A exceção é o fluor- único elemento mais eletronegativo que o xoigênio formando o composto (Floreto de oxigênio) que não é óxido.
Bases fortes → bases dos metais da família 1A e 2A.
Bases fracas → bases dos demais metais, Be(OH)2, Mg(OH)2 e NH4OH.
Alunas Naiana e Mayara colegio Cieac turno vespertino 2º Ano turma 05
Exceção: O hidróxido de amônio (NH4OH) é uma base solúvel, mas que apresenta um pequeno grau de ionização, desta forma, esta base é classificada como solúvel e fraca.
Óxido
Óxidos são compostos binários em que o elemento oxigênio apresenta número de oxidação igual a -2 e é o mais eletronegativo da fórmula tornado-o o mais potente elemento.
As propriedades de um óxido dependem das características esperticunstulares do elemento formador.
Classificação dos óxidos
| classificação | formadores | exemplos |
|---|---|---|
| básicos | metais com nox +1 ou +2 e do grupo 1A e 2A | CaO, FeO, K2O |
| ácidos ou anidridos | metais com nox +5, +6 e +7 e ametais com qualquer nox, exceto C+2, N+1 e N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Os mais comuns são formados pelos metais Al, Mn, Zn, Pb e Sn | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mistos ou duplos | metais com nox médio +8/3 | Pb3O4, Fe3O3 |
Obs: os óxidos anfóteros se comportam como óxidos básicos na presença de ácidos e como óxidos ácidos na presença de bases.
Obs2: os óxidos mistos são a "soma" dos óxidos formados por um elemento, ou seja, é uma nuvem com todos os tipos de óxidos desse elemento:
- FeO + Fe2O3 → Fe3O4
Nomenclatura dos óxidos
a) para qualquer óxido- prefixo + óxido de + prefixo + elemento
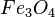 = tetróxido de triferro
= tetróxido de triferro
 = trióxido de dinitrogênio
= trióxido de dinitrogênio
- óxido de + elemento
 - óxido de sódio
- óxido de sódio
 - óxido de alumínio
- óxido de alumínio
- óxido + elemento + sufixo OU óxido de + elemento + nox em algarismo romano
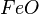 = óxido ferroso ou óxido de ferro II
= óxido ferroso ou óxido de ferro II
 = óxido férrico ou óxido de ferro III
= óxido férrico ou óxido de ferro III
- anidrido + prefixo + elemento + sufixo
| nox | prefixo | sufixo |
|---|---|---|
| +1 ou +2 | hipo | oso |
| +3 ou +4 | - | oso |
| +5 ou +6 | - | ico |
| +7 | (hi)per | ico |
Exceções: para os elementos B+3, C+4 e Si+4 só se usa o sufixo "ico".
Exemplos:
 = anidrido carbônico
= anidrido carbônico
 = anidrido permangânico
= anidrido permangânico
Nomenclatura dos peróxidos
- peróxido de + elemento
Nomenclatura dos superóxidos
- superóxido de + elemento
Sais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um cátion diferente de
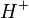 e pelo menos um ânion diferente de
e pelo menos um ânion diferente de  . São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.
. São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidade
Obs2: Como os sais são essencialmente iônicos
Classificação dos sais
a) de acordo com a presença de oxigênio- Sais halóides: não possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Oxissais: possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Sal normal: é formado pela neutralização completa entre um ácido e uma base. Não possui nem H+ nem OH-
- Exemplo:

- Exemplo:
- Hidrogenossal ou hidroxissal: é formado numa reação de neutralização quando o ácido e a base não estão em proporção estequiométrica. Sendo assim, há uma neutralização parcial, sobrando H+ ou OH-
- Exemplo (hidrogenossal):

- Exemplo (hidroxissal):
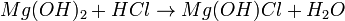
- Exemplo (hidrogenossal):
- Sal misto: o sal apresenta em sua fórmula mais de um cátion ou mais de um ãnion diferentes. É formado a partir da neutralização de um ácido por mais de uma base ou de uma base por mais de um ácido.
- Exemplo:

- Exemplo:
Nomenclatura dos sais
a) para sais halóides- ametal + eto de cátion
b) para oxissais
Usamos uma extensão da tabela de óxidos ácidos e oxiácidos, pois a nomenclatura dos oxissais também depende do nox.
| - | - | óxidos ácidos e oxiácidos | oxissais |
|---|---|---|---|
| nox | prefixo | sufixo | sufixo |
| +1 ou +2 | hipo | oso | ito |
| +3 ou +4 | - | oso | ito |
| +5 ou +6 | - | ico | ato |
| +7 | (hi)per | ico | ato |
Exceções: Como os elementos B+3, C+4 e Si+4 só possuem sufixo "ico" na forma de ácido, quando sais, usa-se sempre o sufixo "ato".
Exemplos:
 (nox N = +3) = nitrito de potássio
(nox N = +3) = nitrito de potássio
 (nox Cl = +1) = hipoclorito de sódio
(nox Cl = +1) = hipoclorito de sódio
 (nox Mn = +7) = permanganato de potássio
(nox Mn = +7) = permanganato de potássio
Monobase → uma hidroxila na fórmula da base.
Ex.: NaOH, KOH, AgOH
 =
= 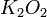
 =
=  =
=  =
=
Nenhum comentário:
Postar um comentário